
|
Hans de Koning, de dagvoorzitter, opent officieel de DARQA Jubileumdag door iedereen welkom te heten, in het bijzonder ook de aanwezige oud-voorzitters, en bedankt de Jubileumcommissie voor haar inzet bij het organiseren van deze dag. Fijn ook dat we dit nu live kunnen doen, na een mislukte poging in 2020 als gevolg van de corona pandemie. |
|
Wel dienen we nog steeds de corona huisregels te volgen.
Hans geeft in het kort een historisch overzicht, waaruit onder meer blijkt dat de DARQA al jaren een stabiel ledenaantal heeft van ongeveer 300 leden afkomstig uit diverse disciplines zoals GLP, GMP, GCP en ICT. Leden die met elkaar in gesprek zijn, netwerken en er met elkaar voor zorgen dat de vereiste kwaliteit binnen al deze disciplines bereikt wordt. Gedurende de jubileumdag gaan we op diverse vlakken kijken naar wat de toekomst met betrekking tot kwaliteit voor ons in petto heeft, kijken naar ‘Quality beyond Compliance’.
Programma voor de dag:
- Willem van Boekel, Kwaliteitsborging: Van last naar lust
- Helena van den Dungen, Farmacovigilantie: de horizon voorbij
- Lunch en in groepen de Reis door de mens bij Corpus doen
- Hans de Raad, Artificial Intelligence; traceability and controllability
- Wilma Meijs, GMP during the development of new products
- Céline Schillinger, Quality as a movement for change
- Borrel en buffet
- Presentatie door Willem van Boekel, Kwaliteitsborging: Van last naar lust.
Hans de Koning introduceert Willem van Boekel. Willem is een ervaren acteur, presentator, trainer en spreker op congressen, symposia en overige bijeenkomsten. Als voormalig presentator van Omdenken beheerst hij alle facetten van het sprekersvak. Hij neemt onderwerpen en mensen uiterst serieus en weet zijn presentatie altijd vrolijk en losjes te houden.

Willem houdt een luchtig verhaal over leiderschap en verbinding in het kader van kwaliteitsborging als last of lust. Willem is zelf geen deskundige op het gebied van kwaliteitsborging en vertelt het verhaal vanuit zijn perspectief. Willem stelt de vraag wat nodig is om zelf de bron te kunnen zijn van een kwaliteitscultuur, waarin je wordt gezien als volwaardig gesprekspartner en niet als politieagent. Hoe zorg je er voor dat je mensen bij je bedrijf houdt, zorg je er voor een goede ontwikkeling en vooral ook werkplezier. Kwaliteit moet een feestje zijn, geen lastig gebeuren. De kwaliteitsmedewerker moet niet die zeurende politieagent en ongewenste overhead zijn die achter de feiten aan loopt doch een gesprekspartner waarmee je samen een kwaliteitscultuur opbouwt en die als leider op zijn/ haar gebied wordt beschouwd. Hierbij rekening houden met:
- persoonlijk leiderschap (je weet wat nodig is en je weet wat je wilt bereiken), en
- samenwerking en verbinding aangaan (geen slachtofferrol nemen en niet afstand houden)
Je kan op twee manieren omgaan met situaties:
- ‘Ja, maar’: dit betekent eigenlijk ‘neen, want’ en betekent daarmee verzet, of
- ‘Ja’: je gaat er 100% voor, maakt een bewuste keus. Hier pak je de verantwoordelijkheid en ga je voor verbinding.
Als voorbeeld doet Willem een spelletje met het publiek waarbij deelnemers volmondig ‘ja’ moeten zeggen en niet ‘ja, maar’. Dit blijkt in de praktijk toch lastig te zijn en komt overeen met wat in het echt gebeurt. Je twijfelt bijna altijd wel, waardoor het moeilijk is direct ja te zeggen. De hersens zijn nu eenmaal zo geprogrammeerd.
Verbinding aangaan is in de praktijk ook lastig, daar we als kind niet geleerd hebben intiem te zijn en daardoor moeite hebben om relaties aan te gaan. Dit leren we op latere leeftijd veelal in workshops e.d. en dan veelal alleen maar oppervlakkig. Net het ijsbergeffect, waarbij 5 niveaus onderscheiden kunnen worden:
- De buitenwereld (gaat niet over jou)
- Feiten over jou als persoon (neutraal/ zakelijk)
- De binnenwereld (wat denk je/ wat voel je/ wat wil je)
- De emoties (huilen/lachen)
- Overtuiging (wat gebeurt er steeds en wat is je overtuiging)
Je moet bij jezelf nagaan welk niveau je belangrijk vindt en welk niveau nodig is om te kunnen verbinden. Daarop moet je dan inspelen.
- Presentatie Helena van den Dungen, Astellas, over Farmacovigilantie: de horizon voorbij.
Helena van den Dungen heeft meerdere professionele thema’s gekend: als pre-klinisch onderzoeker was zij werkzaam op het gebied van de neuro-endocrinologie (PhD: Vrije Universiteit Amsterdam). Daarna is ze werkzaam geweest als inspecteur bij de IGZ (IGJ), waarbij ze verantwoordelijk was voor GLP-, GCP- en PV-inspecties in Nederland. Na de oprichting van de EMA leidde Helena de eerste EMA Centrale Procedure inspecties voor GCP en voor PV. Sinds 2007 werkt zij voor de farmaceutische industrie als Global Head Pharmacovigilance QA.

Helena geeft aan dat Farmacovigilantie (Pharmacovigilance, PV) geneesmiddelbewaking betekent. Binnen de DARQA zijn er niet zo heel veel leden mee bezig. Alhoewel een korte poll in de zaal aangeeft dat er van de aanwezige leden toch zo’n 5 zich hier mee bezig houden. Iedereen is eigenlijk wel bezig met PV, immers bij het slikken van bijvoorbeeld een paracetamol check je de bijsluiter en weet je wat de bijwerkingen en risico’s kunnen zijn.
PV is een samenspel van patiënt, dokter, producent en regulatoire autoriteit en een gedeelde verantwoordelijkheid. O.a. alle bijwerkingen dienen gemeld en bijgehouden te worden in een centrale database. In deze database wordt alle informatie verzameld afkomstig van alle betrokken groepen, naast bovenstaande inclusief leverancier, QA en QP. PV doe je al vanaf de ontwikkelingsfase van een geneesmiddel, om zo alle relevante informatie te kunnen bijhouden.

In de 40 jaar dat de DARQA bestaat is veel veranderd, zoals nu worden alle adverse events en bijwerkingen gemeld en bijgehouden terwijl je in het verleden wachtte tot er een keer iets gebeurde. Vroeger werd alles paper-based gedaan, nu wordt alles via geautomatiseerde systemen bijgehouden. Om de verantwoordelijkheid duidelijk te maken is de positie van QPPV (Qualified Person Pharmacovigilance) geïntroduceerd.
In 2012-2013 is de nieuwe wetgeving rondom PV van kracht geworden, de ‘Good Pharmacovigilance Practice’ (GVP). Dit is een modulair systeem, waarin middels meerdere modules de regelgeving is vastgelegd.
Een veiligheidssignaal over een geneesmiddel kan al door een enkele adverse event tot stand komen alsmede door b.v. een klinisch rapport of een bericht dat het geneesmiddel niet werkt. Bijwerkingen van een geneesmiddel worden bijgehouden in een risicoprofiel.
Het effect van PV is nu duidelijk zichtbaar bij de Covid-19 vaccins. Doordat alles zo goed wordt bijgehouden en openbaar is, zijn er veel publieke reacties (ook doordat de consument meer/betere informatie eist), waarbij vooral ook de social media in positieve en negatieve zin bijdragen aan beeldvorming.
Helena stelt de vraag of Quality beyond compliance wel mogelijk is voor PV, zoals het vermijden/voorkomen van adverse events? Een aantal zaken kan zeker beter en zal de komende tijd aandacht (moeten) krijgen, zoals:
- Managen van verwachtingen: er zijn bijwerkingen, deze kunnen we accepteren en er mee leren omgaan. Van te voren aangeven welke kwaliteit we kunnen verwachten.
- Actief op zoek gaan naar bijwerkingen (niet afwachten tot er wat gebeurt). Des te meer we weten des te beter kan je risico’s minimaliseren.
- De patiënt centraal stellen (wat heeft een patiënt echt nodig).
- Lunch en reis door de mens
De dag wordt vervolgd met een lekkere lunch voor de deelnemers.
Tijdens de lunch hadden de aanwezigen de gelegenheid om Corpus te bezoeken. Door de Coronavoorschriften met mondkapje en in kleine groepen van ca. 10-12 personen. Uiteraard was dit ook een mooi moment om elkaar beter te leren kennen. Het bezoek aan Corpus betrof een 55 minuten durende, spectaculaire, ‘reis door de mens’. De reis startte in de knie en eindigde in de hersenen. Middels een audiotour hebben we geleerd hoe het menselijk lichaam werkt. Leuk was het 5D-harttheater waarbij we een ‘reis’ als rood bloedlichaampje hebben gedaan. Daarnaast mee-ademen mee in de longen, springen op de tong en lopen door het oor. De werking van ons lichaam blijft indrukwekkend.

- Presentatie Hans de Raad, OpenNovations over Artificial Intelligence; traceability and controllability
Hans de Raad heeft tientallen jaren ervaring in softwarebeveiliging, data- integriteit en IT ontwikkeling en validatie, zowel voor de overheid als voor verschillende laboratoria. Ook heeft hij ruim ervaring als kwaliteits- en compliance consultant voor verschillende grote farmaceutische bedrijven.

Hans houdt een interessant verhaal over het toepassen van Artificial Intelligence (AI). Valideren van AI is echter lastig want echte AI bestaat nog niet (‘AI: INTELLIGENCE IS WHATEVER MACHINES HAVEN'T DONE YET’).
Al in de jaren 50 van de vorige eeuw werd al een concept neergelegd voor AI, dit was toen nog echte science fiction. In de jaren ‘70 ontstond het idee om menselijke intelligentie te imiteren, maar die jaren werden ook gekenmerkt door een soort van AI winter omdat ontwikkelingen stilstonden. Er was ook een soort van tunnelvisie omdat steeds maar één bepaald onderwerp werd opgepakt. Pas in de jaren ‘90 kwam hier verandering in en werd gestart met zogenaamde neurale netwerken, een cluster van netwerken. Daaruit ontstond o.a. de supercomputer die onder meer in staat was de wereldkampioen schaken Kasparov te verslaan. Vanaf 2000 worden de eerste toepassingen hiervan ook gedaan in de medische wereld.
Iets dat bewezen mogelijk is met een computer is geen AI meer. AI is of generiek, d.w.z. een systeem dat meerdere menselijke activiteiten nabootst, of smal, d.w.z. kan slechts een paar specifieke taken doen. Zowel AI als zogenaamde ‘Big data’ streven beiden na om antwoorden te vinden op vragen die we hebben over o.a. het heelal en het leven. Diverse grote bedrijven zijn hiermee bezig, zoals IBM, MicroSoft en Google. Ten aanzien van AI bij de Medische Technologie worden de volgende eisen gesteld:
- Accountability (verantwoordelijkheid vastleggen)
- Human agency & oversight (de mens houdt toezicht op de werking)
- Transparancy (duidelijk zijn wat de doelstelling is)
- Technical robustness & safety (ontwerp moet robuust en veilig zijn)
Bij de bediening en opvolging van AI geldt de volgorde: interpretatie → actie → wijziging van de omgeving. Voorbeeld hiervan is een algoritme dat ontstaat bij een smart watch bij het tandenpoetsen. De smart watch merkt elke ochtend het tandenpoetsen doordat elke ochtend 1 minuut de arm beweegt. Dit leidt tot een dagelijks signaal om de tanden te gaan poetsen.
De machine kan zelf ook gaan leren, dit kan onder supervisie (wij bepalen), versterkt (wij voegen toe) of zonder supervisie (waarbij de AI zelf leert en bepaalt wat te doen).
AI betekent niet dat mensen vervangen worden, maar AI kan gezien worden als een hulpmiddel om problemen op te lossen en de hoeveelheid data te reduceren. Bij medische toepassingen wordt AI gebruikt voor onder meer Beeld-/gegevensverwerking en classificaties en voor diagnostiek en behandeling (b.v. hartmonitoring). Binnen de Farma wordt AI onder meer gebruikt voor:
- Environmental monitoring: continue monitoring van de cleanrooms
- Equipment performance: Analyseren van apparatuurgegevens (b.v. vaststellen compressorstoring op koelkasten/vriezers)
- Competence management: Training record/HR analysis
- CAPA trend analysis: Evaluatie van prestaties in de loop van de tijd
- Continue data-acquisitie en -analyse gedurende de levenscyclus van een product (QA en PV)
- Van ontwerp- en ontwikkelingsverificaties en -validaties tot continue monitoring (QA en PV)
Al met al is AI veelbelovend, maar moeten we het wel continu in de gaten houden (controle cycli inbouwen, data integriteit e.d.). Het mag geen deep fake worden (ook dit is een vorm van AI).
- Presentatie door Wilma Meijs: GMP during the development of new products
Wilma behaalde haar master titel in biochemie en vervolgens in 1996 haar doctors titel in geneeskunde. Hierna ging ze bij TEVA aan de slag als QC-manager. Sindsdien heeft Wilma bij verschillende bedrijven gewerkt binnen QC en QA afdelingen en/ of als QP. Ze heeft zowel ervaring met kleine moleculen als met biotechnologische producten en is sinds 2003 ook betrokken geweest bij de ontwikkeling van nieuwe farmaceutische geneesmiddelen.

GMP dient al gedaan te worden tijdens de ontwikkeling van geneesmiddelen, sowieso vanaf de voor de patiënt relevante fasen. Je begint met Good Science Practice (GSP), gevolgd door Good Development Practice (GDevP) en vervolgens GMP.
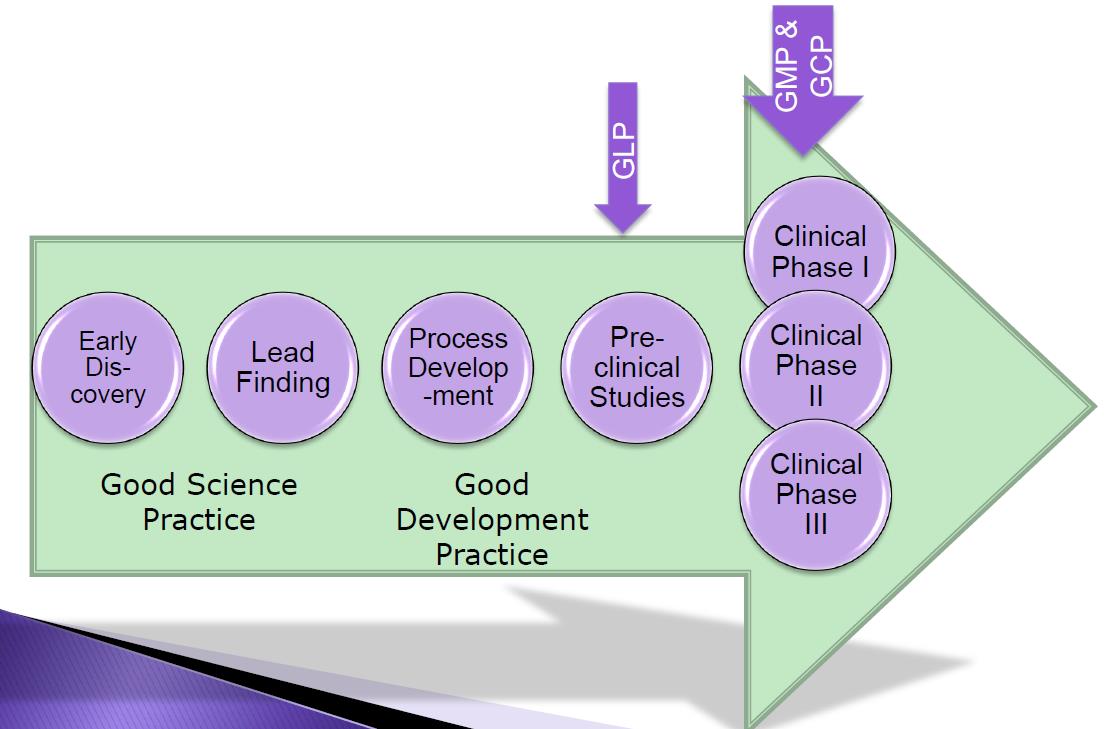
In het traject van GSP → GDevP → GMP ga je in toenemende mate GMP-kwaliteitssystemen gebruiken. Voorbeelden hiervan:
- Zowel bij GSP als GdevP en GMP dient het personeel getraind en gekwalificeerd te zijn voor het werk dat ze uitvoeren.
- Apparatuur- en faciliteitkwalificatie hoeft in de GSP-fase minder stringent te zijn dan bij GDevP en GMP. Kalibratie is (uiteraard) wel in alle gevallen volledig uitgevoerd. Apparatuur kwalificatie is bij GMP een wettelijke vereiste.
- De mate van documentatie neemt ook toe in de route GSP → GDevP → Wel van groot belang is het borgen van kennis (kennismanagement). De ontwikkeling van geneesmiddelen dient goed vastgelegd te worden in protocollen en rapportages (ook relevant voor het schrijven van het registratiedossier). Tijdens de preklinische fase dienen er al batchrecords en procedures te zijn om vast te leggen hoe het geneesmiddel is bereid en volgens welke methode. Vanaf de GdevP fase dient al 100% datareview gedaan te worden (en dient de data integrity gewaarborgd te zijn).
- Deviation handling (afhandelen van afwijkingen) dient volledig in werking te zijn vanaf klinische fase I, dit hoeft minder te zijn tijdens de ontwikkelingsfase en de preklinische studies. Wel is verstandig al vroeg te beginnen met afwijkingen vast te leggen en op te lossen, omdat je hiervan leert en het nodig is voor zowel kennismanagement als voor het proces van continu verbeteren (ook een GMP vereiste).
- Change control (vastleggen van wijzigingen) dient al grotendeels (ca. 80%) in plaats te zijn vanaf de preklinische studies, maar ook daarvoor dien je er al rekening mee te houden vanwege het opbouwen van kennis en in het kader van continu verbeteren. Vanaf klinische fase I dien je 100% change control te gebruiken.
- Procesvalidatie bouw je langzaam op in het traject GSP → GDevP → GMP. Bij klinische fase I hou je er al rekening mee bij bepaalde (kritische) (proces)stappen, vanaf klinische fase III is het 100%. Tijdens je ontwikkelingsfase dien je de principes van Quality by Design (QBD) en Design of Experiments (DOE) toe te passen om het productieproces robust te maken leidend tot een kwalitatief goed product.
- Assay validatie bouw je ook langzaam op in het traject GSP → GDevP → GMP. Ook in je preklinische fase is het al verstandig goed ontwikkelde en gekwalificeerde assay methodes te gebruiken, vanaf klinische fase III dienen alle testmethodes volledig gevalideerd te zijn (klinische fase II al grotendeels).
- Stabiliteitsstudies begin je al zo snel mogelijk mee (in ieder geval al vanaf de preklinische studies) om een zo goed mogelijk beeld op te bouwen over de stabiliteit van het geneesmiddel. Indien nodig kan je nog bijsturen.
In het gehele ontwikkelingstraject GSP → GDevP → GMP is betrokkenheid van QA en de QP noodzaak. Mede ook om te borgen dat procedures op de juiste manier worden opgenomen in het kwaliteitssysteem. Implementatie van opgebouwde en vastgelegde kennis (Kennismanagement), herleidbaarheid van gegevens en vooral ook de dataintegriteit (betrouwbaar, nauwkeurig, reproduceerbaar) zijn in het ontwikkelingstraject van het grootste belang.
- Presentatie door Céline Schillinger, France’s business woman of the year 2013, La Tribune (The woman that transformed Sanofi) met Quality as a movement for change
Céline is Head Innovation & Engagement bij Sanofi Pasteur, waar ze sociale media op een innovatieve manier benut om de farmaceutische industrie wakker te schudden en zo levens te redden. Voordat ze in 2001 bij Sanofi in dienst trad heeft zij bij andere bedrijven gewerkt, onder andere in Vietnam en China. In 2011 heeft ze het Women Empowerment Network bij Sanofi opgericht met als doel om een grotere vertegenwoordiging van vrouwen in de top van het bedrijf te bewerkstelligen en tot betere bedrijfsresultaten te komen. Daarnaast heeft zij de Break Dengue Community opgericht, een samenwerkingsverband tussen verschillende initiatieven gericht op het wereldwijd terugdringen van dengue koorts, waarvoor zij diverse prestigieuze prijzen heeft ontvangen.

Céline hield een erg interessant en aansprekend verhaal over kwaliteit als ‘movement for change’ bij Sanofi. Céline kwam er in 2010 achter dat bij Sanofi weinig beweging zat in het uitvoeren van veranderingen. Men zat vastgeroest in oude ideeën, het was bureaucratisch en men was erg territoriaal. Het was veiliger om niets te doen. Senior management was ook niet divers in die zin dat het vooral bestond uit witte mannen.
Als gevolg van het matige beleid bij Sanofi was het kwaliteitsniveau erg laag en werd ca. 1/6e van de producten door slechte kwaliteit afgekeurd en vernietigd. Met de komst van een nieuwe Chief Quality Officer kwam hier verandering in en werd besloten het roer om te gooien. Kwaliteit werd hierbij de basis voor het doorvoeren van veranderingen. Céline kreeg de kans om deze veranderingen door te voeren en heeft e.e.a. in gang gezet om meer diversiteit te creëren met een heel andere aanpak. O.a.:
- Niet meer een nieuw product ontwikkelen en dit in de markt duwen, maar een product ontwikkelen nadat is achterhaald waar de gebruiker nu echt op zit te wachten.
- Niet meer zo maar iets opdragen, maar in gesprek gaan met medewerkers
- Niet meer domweg regels opstellen maar zorgen voor bewustwording
- Niet meer star zijn maar flexibel
- Betrokken management (engaged leadership)
Uitgangspunt werd ook het personeel zelf de wijzigingen te laten doorvoeren. Hiervoor zijn improvement teams opgezet; groepjes mensen die naast hun werk verbeteringen doorvoeren. Experts samen met vrijwilligers. Dit heeft er toe geleid dat mensen beter gemotiveerd werden, goed gingen samenwerken, met als resultaat minder afkeur en geen warning letters meer van de FDA. Ook nieuwe medewerkers, waar in het verleden de integratie nogal eens te wensen over liet, werden gekoppeld aan buddies om een goede integratie in Sanofi te waarborgen. Door middel van de introductie van Yammer als communicatiemiddel werd ook een betere connectiviteit tussen mensen gewaarborgd.

Door de movement of change en het invoeren van betrokken leiderschap werd een collectieve efficiency slag gecreëerd, resulterend in onder meer:
- Betere kwaliteit
- Toenemende vaardigheden
- Reductie van risico’s
- Grotere veiligheid
- Hersteld vertrouwen
- Verbeterde reputatie
- Afsluiting
De afsluiting van de geslaagde dag wordt weer verzorgd door Hans de Koning die nogmaals alle presentatoren bedankt voor hun bijdrage en de DARQA-leden voor hun aanwezigheid, enthousiasme en gezelligheid.
De dag eindigt met de traditionele borrel, gevolgd door een goed verzorgd buffet.









